INTRODUCCIÓN
Los gases se forman cuando la energía de un sistema excede todas las fuerzas de atracción entre moléculas. Así, las moléculas de gas interactúan poco, ocasionalmente chocándose. En el estado gaseoso, las moléculas se mueven rápidamente y son libres de circular en cualquier dirección, extendiéndose en largas distancias. A medida que la temperatura aumenta, la cantidad de movimiento de las moléculas individuales aumenta. Los gases se expanden para llenar sus contenedores y tienen una densidad baja. Debido a que las moléculas individuales están ampliamente separadas y pueden circular libremente en el estado gaseoso, los gases pueden ser fácilmente comprimidos y pueden tener una forma indefinida.
El comportamiento de todos los gases se ajusta a tres leyes, las cuales relacionan el volumen de un gas con su temperatura y presión. Los gases que obedecen estas leyes son llamados gases ideales o perfectos.
OBJETIVOS
MARCO TEÓRICO
Todo en el Universo está formado por materia. La materia se puede encontrar en 3 estados de agregación o estados físicos: sólido, líquido y gaseoso. Para entender los diferentes estados en los que la materia existe, es necesario entender algo llamado Teoría Molecular cinética de la Materia. La Teoría Molecular cinética tiene muchas partes, pero aquí introduciremos sólo algunas. Uno de los conceptos básicos de la teoría argumenta que los átomos y moléculas poseen una energía de movimiento, que percibimos como temperatura. En otras palabras, los átomos y moléculas están en movimiento constante y medimos la energía de estos movimientos como la temperatura de una sustancia. Mientras más energía hay en una sustancia, mayor movimiento molecular y mayor la temperatura percibida. Consecuentemente, un punto importante es que la cantidad de energía que tienen los átomos y las moléculas (y por consiguiente la cantidad de movimiento) influye en su interacción. Los átomos que tienen poca energía interactúan mucho y tienden a "encerrarse" y no interactuar con otros átomos. Por consiguiente, colectivamente, estos átomos forman una sustancia dura, lo que llamamos un sólido.

Los átomos que poseen mucha energía se mueven libremente, volando en un espacio y forman lo que llamamos gas. Los gases se forman cuando la energía de un sistema excede todas las fuerzas de atracción entre moléculas. Así, las moléculas de gas interactúan poco, ocasionalmente chocándose. En el estado gaseoso, las moléculas se mueven rápidamente y son libres de circular en cualquier dirección, extendiéndose en largas distancias. A medida que la temperatura aumenta, la cantidad de movimiento de las moléculas individuales aumenta. Los gases se expanden para llenar sus contenedores y tienen una densidad baja. Debido a que las moléculas individuales están ampliamente separadas y pueden circular libremente en el estado gaseoso, los gases pueden ser fácilmente comprimidos y pueden tener una forma indefinida.
LOS GASES
El comportamiento de todos los gases se ajusta a tres leyes, las cuales relacionan el volumen de un gas con su temperatura y presión. Los gases que obedecen estas leyes son llamados gases ideales o perfectos. En el siguiente informe estudiaremos la ley de Boyle y Mariotte y la ley de Charles y Gay-Lussac. ley general de los gases o ecuación general de los gases Las leyes parciales analizada precedentemente pueden combinarse y obtener una ley o ecuación que relaciones todas las variables al mismo tiempo.
LEYES DE LOS GASES
La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases ideales que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es inversamente proporcional a la presión:
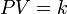
Cuando aumenta la presión, el volumen disminuye, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante K para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
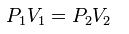
La Ley de Charles, es una de las leyes de los gases ideales. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenido a una presión constante, mediante una constante de proporcionalidad directa. En esta ley, Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura el volumen del gas disminuye. Esto se debe a que la temperatura está directamente relacionada con la energía cinética (debida al movimiento) de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
La ley de Charles es una de las leyes más importantes acerca del comportamiento de los gases, y ha sido usada en muchas aplicaciones diferentes, desde para globos de aire caliente hasta en acuarios. Se expresa por la fórmula:
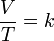
- Variables que afectan el comportamiento de los gases:
1. PRESIÓN
Es la fuerza ejercida por unidad de área. En los gases esta fuerza actúa en forma uniforme sobre todas las partes del recipiente.
La presión atmosférica es la fuerza ejercida por la atmósfera sobre los cuerpos que están en la superficie terrestre. Se origina del peso del aire que la forma. Mientras más alto se halle un cuerpo menos aire hay por encima de él, por consiguiente la presión sobre él será menor.
2. TEMPERATURA
Es una medida de la intensidad del calor, y el calor a su vez es una forma de energía que podemos medir en unidades de calorías. Cuando un cuerpo caliente se coloca en contacto con uno frío, el calor fluye del cuerpo caliente al cuerpo frío.
La temperatura de un gas es proporcional a la energía cinética media de las moléculas del gas. A mayor energía cinética mayor temperatura y viceversa.
La temperatura de los gases se expresa en grados kelvin.
3. CANTIDAD
La cantidad de un gas se puede medir en unidades de masa, usualmente en gramos. De acuerdo con el sistema de unidades SI, la cantidad también se expresa mediante el número de moles de sustancia, esta puede calcularse dividiendo el peso del gas por su peso molecular.
4. VOLUMEN
Es el espacio ocupado por un cuerpo.
5. DENSIDAD
Es la relación que se establece entre el peso molecular en gramos de un gas y su volumen molar en litros.
PROCEDIMIENTO EXPERIMENTAL MATERIALES
Mechero Bunsen
Tapón horadado para el Erlenmeyer
Bureta de 50 ml
Soporte universal
Jeringa grande y embolo
Malla con asbesto
Termómetro de 0 − 100°𝐶
Pinzas y nuez
Pera de nivel
Trípode
Regla graduada de un metro
Manguera de látex
Erlenmeyer de 25 ml
Probeta de 10 ml
LABORATORIO YENKA
PRUEBAS DE LLAMA
PRUEBA DE GASES
CONCLUSIONES
- A una presión constante el volumen de un gas se expande cuando se calienta y se contrae cuando se expande.
- La temperatura y el número de moles para demostrar la ley de Boyle deben ser constantes.
- La presión para demostrar la ley de charle debe ser constante.
- Si la presión de un gas se duplica el volumen disminuye, y si la presión disminuye el volumen aumenta.
WEBGRAFIA
- http://www.juntadeandalucia.es/averroes/recursos_informaticos/andared02/leyes_gases/
- http://www.educaplus.org/gases/gasesreales.html


BUEN TRABAJO 5,0
ResponderBorrar